Reduktion von Kupferoxid quantitativ
Das Gesetz von den konstanten Proportionen (Gesetz der konstanten Massenverhältnisse) lässt sich experimentell auf verschiedenste Weise nachweisen. Oft macht man beim Klassiker im Schülerversuch (Bildung von Kupfersulfid) ein längeres Gesicht, weil die Werte nicht besonders gut hinhauen.
Immer funktioniert hingegen der folgende Versuch, auch wenn dieser etwas höhere Ansprüche an den Experimentator stellt und daher nur als Lehrerversuch sinnvoll ist. Dabei wird Kupfer(II)oxid (schwarz) mit Hilfe von Wasserstoff zu elementarem Kupfer und Wasser reduziert gemäß:
CuO + H2 → Cu + H2O
Das Wasser entsteht dabei in gasförmigem Aggregatzustand und „nimmt“ den Sauerstoff dadurch mit, sodass man durch Massenvergleich vor und nach der Reaktion das Massenverhältnis von Kupfer und Sauerstoff in der Verbindung Kupfer(II)oxid bestimmen kann.
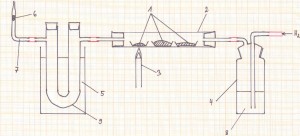
Dazu verwende ich in der Luxusausstattung folgende Apparatur:
Legende:
- Magnesiaschiffchen mit unterschiedlichen Stoffportionsmassen von Kupferoxid
- Reaktionsrohr aus Quarzglas
- Gasbrenner
- Waschflasche
- Wasserbad
- Eisenwolle (locker gestopft)
- gewinkeltes Glasrohr
- Wasser oder Schwefelsäure (konz.) wenn der Wasserstoff getrocknet werden muss
- U‑Rohr
Zunächst wird das Leergewicht aller Schiffchen auf der Feinwaage (d=0,01g) bestimmt. Danach füllt man jedes Schiffchen mit einer anderen Masse an Kupferoxid und wiegt erneut, sodass die Masse des eingefüllten Kupferoxids jeweils bekannt ist. Anschließend werden alle Schiffchen mit einer langen Pinzette in das schon waagerecht eingespannte Reaktionsrohr geschoben und die Apparatur verschlossen.
Nun muss gründlich mit Wasserstoff gespült werden (Knallgasprobe mit Reagenzglas am Auslass nicht vergessen!!!). Danach kann der Wasserstoff an der Austrittsöffnung entzündet werden. Es sollte eine Flamme von ungefähr 3–4cm Höhe mit dem Ventil an der Gasflasche einreguliert werden.
Jetzt werden die Schiffchen nacheinander mit der rauschenden Gasbrennerflamme erhitzt, wobei man mit dem Schiffchen beginnt, welches sich am dichtesten an der Waschflasche befindet. Irgendwann wandert dabei eine glühende Front durch das Kupferoxid, die ein rotes Pulver hinterlässt. Gleichzeitig entsteht im Reaktionsrohr ein durchsichtiger, klarer Beschlag (Wasser), den man mit Hilfe der Brennerflamme in Richtung U‑Rohr treibt, bevor man sich das nächste Schiffchen vornimmt. Während der Reaktion wird die Wasserstoffflamme am Auslass merklich kleiner.
Nachdem das letzte Schiffchen durchgeglüht ist, lässt man kurz abkühlen, entfernt danach die Schiffchen aus der Apparatur und wiegt erneut, sodass man die Masse des umgesetzten Sauerstoffs erhält. Mit durch Differenzbildung mit der Masse des Kupferoxids lässt sich die Masse des Kupfers bestimmen. Im U‑Rohr setzt sich eine durchsichtige, klare Flüssigkeit ab, die man z.B. mit weißem Kupfersulfat als Wasser identifizieren kann.
Die ganze Geschichte braucht mindestens zwei Unterrichtsstunden (1x Versuch, 1x Auswertung), die auch an verschiedenen Tagen stattfinden können. Bei Hantieren mit Wasserstoff ist wie immer äußerste Vorsicht geboten, z.B. eine Sicherheitsscheibe vor das Experiment zu stellen und seitens des Lehrers ein Schutzbrille zu tragen. Folgende Herausforderungen können eintreten:
- Das Reaktionsrohr kann reißen (selten). Dann gibt es kurzzeitig eine größere und mittelfristig eine kleine Wasserstoffflamme
- Verwendet man eine Waschflasche mit Schliff, muss dieser fest sitzen, da Wasserstoff sehr flüchtig ist und man mit der Gasbrennerflamme doch sehr in Nähe selbiger kommt. Dann gibt es hübsche Wasserstoffllammen am Schliff mit der geringen Gefahr, dass durch die Apparatur Luft nachgezogen wird.
- Gummistopfen können dabei gerne einmal abrauchen – da müssen die aber durch, nur brennen sollten sie nicht!
Eigentlich ist die Apparatur durch die Sicherheitswaschflasche (Schutz der Gasflasche) und die Eisenwolle am Auslass (Rückschlagschutz und „Luftsperre“ im Notfall) recht sicher, wenn man die Knallgasprobe wirklich ernst nimmt.
Man kann bei Einführung der Atommasse sinnvoll erweitern, indem man das Anzahlverhältnis der an der Verbindung „Kupferoxid“ beteiligten Atome anhand der Atommasse berechnen lässt. Das geht auch ohne die Avogadro’sche Zahl – irgendwann mehr dazu.
Ich werte das gerne mit einer via Beamer projezierten OpenOfficeCalc-Tabelle (hier einmal mit realen Messwerten versehen) aus – jede andere Tabellenkalkulation oder die gute, alte Tafel oder der grafikfähige Taschenrechner der SuS mit Tabellenblattfunktion (freut sich der Mathelehrer) gehen natürlich auch.