Nukleophile Substitution vs. Eliminierung
Viele Versuchsvorschriften für die elektrophile Substitution gehen von Stoffen aus, deren Handhabung im schulischen Kontext mittlerweile sehr kritisch gesehen, wenn nicht sogar gänzlich untersagt ist. Durch Zufall bin ich im Netz auf ein Praktikumsskript gestoßen, welches viele didaktische Potentiale bietet ohne dabei mit überaus schädlichen Substanzen zu operieren. Gleichwohl gehört auch dieser Versuch nicht in Schülerhand. Der Versuch klappt ganz hervorragend.
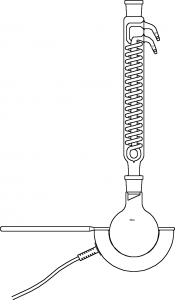
90mL konzentrierte, rauchende Salzsäure werden mit ca. 25mL tertiären Butylalkohol (2‑Methyl-Propan-2-ol) in einem 500mL Rundkolben unter Rückfluss mit einem elektrischen Heizpils ca. 15 Minuten zu Sieden erhitzt (Siedesteinchen nicht vergessen). Die Apparatur sollte nach unten hin so viel „Luft lassen“, dass man den Heizpils jederzeit absenken und so das Innere des Kolbens gemeinsam mit den SuS betrachten kann.
In dem anfangs homogenen Gemisch bilden sich während des Versuches zwei Phasen aus: Eine wässrige, leicht gelbliche unten, und eine klare, farblose oben. Die wässrige Phase wird nach dem Abhkühlen unter dem Abzug mit einem Scheidetrichter abgetrennt und nach einem Mischversuch mit Wasser verworfen, die organische Phase im Idealfall mit Natriumhydrogencarbonatlösung mehrfach gewaschen, bis keine saure Reaktion mehr eintritt. Auch hier bietet sich mit einem Teil ein Mischversuch mit einem polaren und einem unpolaren Lösungsmittel an, um die hydrophoben Eigenschaften nachzuweisen.
Die organische Phase entfärbt danach schwach konzentriertes Bromwasser (Probe mit Bromwasser in einem Reagenzglas schütteln) und zeigt zusätzlich eine positive Beilsteinprobe. Da gibt es dann eine ganze Menge auszuwerten und zu deuten.
Was geschieht bei dem Versuch?
So oder so bildet sich intermedär ein durch die drei Methylgruppen am tertiären Alkohol ein durch den +I‑Effekt stabilsiertes Carbeniumion (P1) gemäß:
Sterische Veränderungen
Man sieht hier den tertiären Alkohol (rechts) im Vergleich zum sich bildenden Carbeniumion (links). Das Carbeniumion ist eigentlich so nicht ganz gelungen, es müsste eigentlich völlig flach (planar) sein, was aber das Java-Plugin nicht hergibt:
|
|
|
Die nukleophile Substitution
Das Proton aus der Salzsäure macht aus der Hydroxygruppe des Alkohols eine gute Abgangsgruppe. Das entstehende, planare Carbenumion lässt einen beidseitigen Angriff des Nukleophils in Gestalt des Chloridions zu:
Es bildet sich 2‑Chlor-2-Methylpropan (P2), welches als Halogenalkan eine positive Beilsteinprobe ergibt und verhältnismäßig ungiftig ist. Dieses Produkt entsteht bei der eingesetzten konzentrierten Salzsäure durch das hohe Angebot an Chloridionen in recht guter Ausbeute. Wer mag, kann die resultierende Ausbeute durch fraktionierte Destillation der organischen Phase ermitteln. Wie man sieht, wird die Salzsäure bei dieser Reaktion verbraucht.
Die Konkurrenzreaktion
Das tertiäre Carbeniumion kann sich auch noch anders stabilisieren, nämlich durch Abgabe eines Protons:
Dabei entsteht 2‑Methylpropen (P3), eine Alken, welches sich quantitativ mit Brom umsetzt und dadurch mit Bromwasser nachweisbar ist. Damit dieser Nachweis wirklich sicher klappt, ist das Waschen mit Natriumhydrongencarbonat notwendig, da sich theoretisch auch restlicher Chlorwasserstoff an die Doppelbindung addieren könnte. Praktisch tritt – zumindest bei mir – die Entfärbung des Bromwassers auch ohne eine solche vorherige Behandlung auf. Wie man sieht, fungiert die Salzsäure bei diesem Reaktionsverlauf lediglich als Katalysator.
Potentiale des Versuches
An dem Versuch lässt sich eine ganze Menge zeigen. Auch eine Diskussion auf Basis des chemischen Gleichgewichtes ist möglich: Warum begünstigt eine hohe Chloridionenkonzentration die nukleophile Substitution? Erfreulicherweise verläuft die ganze Geschichte nach SN1 bzw. E1 , da ein recht stabiles, tertiäres Carbeniumion intermediär auftritt, was mechanistische Schreibverrenkungen deutlich reduziert. Wer will, kann auch noch vom Molekülbau auf physikalischen Eigenschaften schließen: Warum ist das Gemisch anfangs homogen und besteht am Schluss aus zwei Phasen? Es gibt eine Menge zu schauen und zu riechen (vorher/nachher – Riechkolben! Chemisch riechen!), die Sache ist recht ungiftig, ungefährlich und außerdem schnell zusammengesteckt.

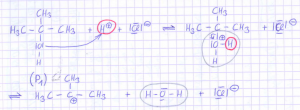
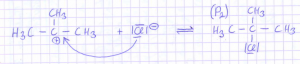
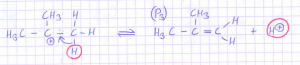

Hi,
ich finde diesen Versuch ziemlich gut und habe ihn auch direkt mal gemacht, um Eliminierung und Substitution noch einmal zu festigen und anschließend mit dem Bromnachweis einen hübschen Einstieg in die elektrophile Addition zu haben. Bei der Vorbereitung klappte die Bromentfärbung auch, allerdings ist das Eliminierungsprodukt ja gasförmig… und daher frage ich mich inwiefern das wirklich in der organischen Phase vorliegen kann? – (es klappte auch nur unmittelbar nach der Aufreinigung).…
Viele Grüße
Sara
Guter Punkt. In gewissem Maße ist es ggf. löslich, in Ethanol und Ether ja sogar gut. Jetzt ist dann ein wenig Recherche angesagt :o)…
Habe den versuch heute im Unterricht eingesetzt – funktioniert ganz hervorragend (sowohl aus experimenteller als auch didaktischer Sicht). Ich habe den Ansatz halbiert und einen entsprechend kleineren Kolben verwendet.
Der eindeutige Nachweis des in Konkurrenz entstehenden Alkens gelingt, indem oben an den Rückflusskühler eine Waschflasche mit Bromwasser angesetzt wird. Dort perlt wenig Gas durch, das aber für allmähliche Entfärbung sorgt.
Bei dem Gas kann es sich nicht um tert.-Butylchlorid und natürlich auch nicht um tert.-Butanol handeln, weil beide am Kühler kondensieren. HCl würde keine Entfärbung verursachen, weil Chloridionen von Brom nicht oxidiert werden. Es bleibt also nur ein Alken, das zudem noch am Kühler vorbei kommt … .
Gutes Gelingen wünscht
Thomas
Danke Thomas für diese nette praktische Erweiterung, die zudem noch einige Rätsel löst :o)…