Die Faradaysche Konstante bestimmen
Manchmal bin ich mir selbst so unheimlich, dass ich gar nicht glauben kann, was ich da eigentlich im Unterricht mit dem zur Verfügung stehenden Material messe. Von irgendwoher habe ich ein Praktikumsscript, in dem die Faradaysche Konstante experimentell mit einem Hoffmannschen Zersetzungsapparat bestimmt wird. Zunächst aber ein bisschen Grundlagen zum Warmwerden.
Das erste Faradaysche Gesetz sagt nichts anderes, als das die bei einer Elektrolyse abgeschiedene Stoffmenge n proportional zur elektrischen Ladung Q ist, die durch den Elekrolyten fließt – mathematisch ausgedrückt:
(1) Q ∼ n
Proportionalitäten haben es so an sich, dass sie über einen Proportionalitätfaktor miteinander verknüpft sind, im Falle des Faradayschen Gesetzes gilt hier:
(2) Q = n * z * F
n ist die Stoffmenge, z ist die Anzahl der bei der Elektrolyse pro Ion ausgetauschten Elektronen und F ist Faradaysche Konstante, die wir haben wollen. z bekommen wir nahezu eliminiert, wenn wir in einem System arbeiten, in dem nur ein Elektron ausgetauscht wird, etwa bei der Reduktion von Protonen:
(3) H+ + e- → H
Mit z = 1 bleibt von Gleichung (2) nur noch:
(4) Q = n * F oder Q = F * n
Das sieht schon sehr nach einer Geradengleichung aus:
(5) y = m * x
wobei m die Steigung ist. Also muss ich nur Q in Abhängigkeit von n bestimmen und die Steigung dieser Geraden sollte dann F sein. So der Plan.
In vielen Versuchsanleitungen wird das gravimetrisch gemacht, d.h. man lagert z.B. einen Feststoff an eine Metallelektrode an, die von Zeit zu Zeit gewogen wird, um die Massenzunahme zu bestimmen. Daraus lässt sich dann n bestimmen. Das ist aber Stress, da man immer das Lösungsmittel vor dem Wiegen wegbekommen muss, dabei sowieso der halbe mühsam hinelektrolysierte Kram abfällt usw.
Wenn man ausschließlich mit Gasen arbeitet und die Stoffmenge indirekt über das gebildete Gasvolumen bestimmt, erspart man sich derartige Probleme, muss jedoch das Ganze als Demonstrationsversuch fahren, da an einer Schule kaum mehr als zwei Zersetzungsapparate zu finden sein werden:
Ich habe als Elektrolyt Schwefelsäure der Konzentration c=1mol/L verwendet. Als Elektrodenmaterial diente Platin. Elektrolysiert wurde bei konstant 0,2A für jeweils zwei Minuten. Danach habe ich das Restgas aus dem Elektrolyten perlen lassen und das Wasserstoffvolumen bestimmt. Beim Hoffmannschen Apparat ist es sehr wichtig, vor dem eigentlichen Versuch bereits etwas Gas zu produzieren, da ansonsten Fehler auftreten können – immerhin ist Sauerstoff in Wasser begrenzt löslich (Wasserstoff nicht so…), die Elektrodenoberfläche muss mit Gas gesättigt sein usw.. Die rohen Messdaten sahen so aus:
| t [min] | V [mL] |
| 2 | 2,8 |
| 4 | 6 |
| 6 | 8,9 |
| 8 | 11,9 |
| 10 | 14,8 |
Erweitert man das Ganze um die Berechnung der Ladungsmenge Q und die Stoffmenge n, die über den Satz von Avogadro erhältlich ist, so ergibt sich (man verzeihe die Genauigkeit, das ist Drag’n Drop aus der Tabellenkalkulation):
| t [min] | V [mL] | n(H) | Q [A*s] |
| 2 | 2,8 | 0,000233333333333333 | 24 |
| 4 | 6 | 0,0005 | 48 |
| 6 | 8,9 | 0,000741666666666667 | 72 |
| 8 | 11,9 | 0,000991666666666667 | 96 |
| 10 | 14,8 | 0,00123333333333333 | 120 |
Die Berechnung von Q ist sehr einfach, da gilt:
(6) Q = I * t (Strom in A multipliziert mit der Zeit in s)
Die Berechnung von n funktioniert wie bereits gesagt über den Satz von Avogadro, hier am Beispiel der des ersten Wertes:
gegeben:
V=2,8mL=0,0028L
gesucht:
n(Gasteilchen) in V=0,0028L
allg, gilt:
Ein Mol Gasteilchen eines idealen Gases (Wasserstoff kommt einem idealen Gas freundlicherweise sehr nahe) nimmt bei einer Temperatur von T=25°C und eine Druck von 1013hPa ein Volumen von ca. 24L ein.
Ansatz:
1mol/24L = x mol/V <=> x=V/24 x=0,0028/(1*24)≈0,000116mol
Da damit die Anzahl der Wasserstoffmoleküle bestimmt wurde, die je zwei Wasserstoffatome enthalten, beträgt die Anzahl der Wasserstoffatome das Doppelte, also
n(H)=2*n(H2)=2*0,000116mol=0,000232mol
Mit den anderen Werten verfährt man entsprechend.
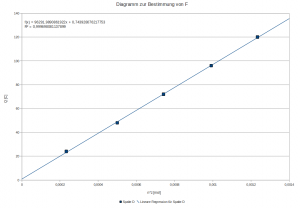
Wenn ich jetzt ein x/y‑Diagramm z.B. mit einer Tabellenkalkulation erstelle (Q gegen n(H) auftragen), sieht das so aus:
Die Faradaysche Konstante ist identisch mit der Steigung der Geraden. Wenn man in OpenOffice auf das Diagramm doppelt klickt und dann oben im Menu „einfügen“ „Trendlinie“ => linear anwählt, kann man sich die zugehörige Geradengleichung und die Fehlerquadrate anzeigen lassen – die Güte dieser Geraden ist schon verdammt gut. Jetzt kommt’s:
Mein Ergebnis: F = 96292 C/mol
Theoriewert: F = 96485,3 C/mol
Das macht einen Fehler von 0,3%. Irgendwas stimmt da nicht… Noch genauere Werte gibt es, wenn man mit den Gasgesetzen etwa noch den hydrostatischen Druck mit berücksichtigt, der durch die Wassersäule entsteht, die durch das Gas verdrängt wird. Dabei führt ein kleineres molares Volumen zu noch genaueren Werten. Ich muss aber sagen, dass in diesem Fall mir die Genauigkeit für den schulischen Bereich absolut reicht… Oder ich hatte einfach nur Schwein…