Zersetzungsspannung
Alle Elemente streben den energieärmsten Zustand, d.h. eine möglichst stabile Elektronenkonfiguration an. In der Regel ist dieser erreicht, wenn in der äußersten Kugelschale acht Elektronen vorhanden sind. Für die Reaktionen von Zink und Brom ergibt sich folgende Reaktionsgleichung:
Zn + Br2 → ZnBr2
Aufgeschlüsselt nach Teilgleichungen für die Oxidation und Reduktion sieht man, dass dabei Elektronen vom Zink zum Brom fließen:
(1) Zn → Zn2+ + 2e- (Oxidation)
(2) Br2 + 2e- → 2Br- (Reduktion)
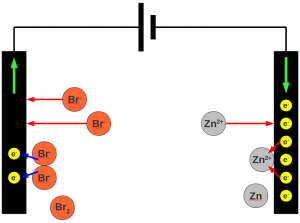
Diese Richtung des Elektronenflusses ist quasi die natürliche: Auf diese Weise erreichen beide Elemente unter Energieabgabe den energieärmsten Zustand. Wenn die Elektronen in die andere Richtung fließen sollen, bedarf es der Zufuhr von Energie, z.B. von elektrischem Strom, den eine „Elektronenpumpe“ wie z.B. eine Batterie liefern kann. Der Prozess lässt sich etwa in einer Elektrolysezelle umkehren, die eine wässrige Lösung von Zinkbromid enthält. Als Elektrodenmaterial dient Graphit – die Wahl dieses Materials ist nicht beliebig. Eine solche Zelle könnte folgendermaßen aufgebaut sein:
Die negativ geladenen Bromidionen werden vom Pluspol (Anode) der Elektrolysezelle angezogen und dort unter Abgabe eines Elektrons entladen. Der Prozess (2) läuft „rückwärts“. Analog werden die Zinkionen von dem Minuspol (Kathode) angezogen und dort unter Aufnahme von Elektronen entladen. Der Prozess (1) läuft „rückwärts“. Beide Prozesse müssen durch eine externe Spannungsquelle erzwungen werden, sodass Elektronen an der Kathode eintreten und an der Anode austreten können (grüne Pfeile).
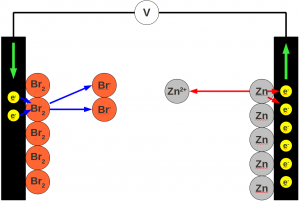
Dafür ist eine bestimmte Mindestspannung, die Zersetzungsspannung erforderlich. Nur nach der Überschreitung der Zersetzungsspannung läuft der Elektrolyseprozess kontinuierlich. Das Phänomen der Zersetzungsspannung lässt sich mit einer galvanischen Zelle erklären, die sich während jeder Elektrolyse ausbildet. Diese lässt sich folgendermäßen skizzieren:
Während der Elektrolyse überziehen sich die Elektronen vereinfacht gesprochen mit einem „Brommantel“ (Anode) und einem „Zinkmantel“ (Kathode). Den Zinkmantel kann man sogar als leichte gräuliche Verfärbung bei der Elektrolyse sehen, den Brommantel durch die dunkle Farbe der Graphitelektrode nicht – dennoch ist Brom an der Oberfläche der Kathode in gewissem Maße adsorbiert. Jetzt passiert etwas Interessantes: Beide Elemente streben die „natürliche“ Reaktionsrichtung an. Es bilden sich zwei Gleichgewichte aus:
(3) Zn ↔ Zn2+ + 2e-
(4) Br2 + 2e- ↔ 2Br-
Zink hat dabei ein geringeres Bestreben, Elektronen an sich zu binden, sodass Gleichgewicht (3) mehr auf der Seite der Produkte liegt als Gleichgewicht (4), da Brom ein höheres Bestreben zur Elektronenaufnahme besitzt. Dadurch lädt sich die Elektrode, an der Zink anhaftet, gegenüber der Elektrode, an der Brom anhaftet, negativ auf. Es entsteht ein sogenanntes elektrochemisches Potential. Würde man das Voltmeter entfernen und die Zelle kurzschließen, flössen Elektronen von der Elektrode mit dem „Zinkmantel“ zur Elektrode mit dem „Brommantel“, also genau in die entgegengesetzte Richtung wie bei der Elektrolyse.
Bizarr: Die Kathode bei der Elektrolyse „möchte“ Elektronen „loswerden“, d.h. Zinkionen zu Zinkatomen reduzieren. Die sich neu bildenden Zinkatome möchten ihrerseits Elektronen an die Elektrode „loswerden“, da sie als Zn(II)-Ion einen wesentlich energieärmeren Zustand besitzen. Die Anode bei der Elektrolyse „möchte“ Elektronen von den Bromidionen aufnehmen, um diese zu elementarem Brom zu oxidieren. Die sich dabei neu bildenden Bromatome „möchten“ ihrerseits Elektronen aus der Elektrode aufnehmen, um zu den wesentlich energieätrmeren Bromidionen zu werden – ein klassische Konkurrenzsituaton.
Die Zersetzungsspannung markiert den Punkt im Geschehen, bei dem die externen Spannungsquelle diese Konkurrenzsituation „für“ sich entscheidet. Dazu muss sie das von der galvanischen Zelle (die erst durch die Elektrolyse entsteht) aufgebaute Potential überwinden. Dieses lässt sich sehr leicht berechnen, wenn wir Standardbedingungen annehmen (25°C, c(Zn2+)=c(Br-)=1mol/L). Dann können wir einfach in in die Spannungsreihe schauen:
(5) Zn ↔ Zn2+ + 2e- UH0=-0,76V
(6) 2Br- ↔ Br2 + 2e- UH0=1,07V
(7) U = UH0 (Akzeptorhalbzelle) – UH0 (Donatorhalbzelle) = 1,07V-(-0,76V)=1,83V
In diesem Fall benötigt man also eine Spannung von mehr als 1,83V, damit die Elektrolyse läuft. Wenn die Konzentrations‑, bzw. Druck- und Temperaturverhältnisse andere sind, muss man die Nernstsche Gleichung zur Berechnung der Halbzellenpotentiale bemühen.
Diese Theorie klingt erst einmal logisch, hat aber ihre Tücken: Bei jeder Elektrolyse fließt bereits ein Strom, bevor die Zersetzungsspannung erreicht wird, was eigentlich nicht sein kann. Bei vielen Elektrolysen, bei denen Gase entstehen, liegt die tatsächliche Zersetzungsspannung höher als die theoretisch berechnete. An anderer Stelle mehr davon.

Pingback: Überspannung - riecken.de - Gedanken zu Bildung, Lehre und Schule