Chemie: Fotometrie mit Kaliumpermanganatlösung
Es gibt Geräte in der Chemiesammlung, um die man als Lehrer einen ehrfurchtsvollen Bogen macht, z.B. eine Gasmolwaage. Für mich gehörte lange Zeit auch das sündhaft teure Fotometer mit dazu, wir besitzen ein Novaspec II mit seriellem Anschluss. Dummerweise steht in diesem Jahr für den Schwerpunktkurs Chemie auf erhöhtem Niveau hier in Niedersachsen das Lambert-Beersche Gesetz auf dem Zettel, sodass man drei Alternativen hat:
- Es als Referat zu vergeben
- Es theoretisch durchzukauen – da gibt es im Netz hervorragende Praktikumsberichte
- In den sauren Apfel zu beißen und es praktisch zu probieren
Ich habe mich mich für die dritte Option entschieden, auch wenn damit die Verbindliche-Abitur-Vorgaben-Macher es damit geschafft haben, Lehrerfortbildung zum Nulltarif zu evozieren.
Ein Kollege ist am vergangenen Freitag extra länger geblieben, um mich in die Geheimnisse dieses Geräts einzuweihen. Glücklicherweise lässt es sich komplett mit einem Laptop fernsteuern – eine Lizenz für die Software AKAnalytik32.NET gibt es an der Schule auch. Mehr braucht es nicht.
Nach einer theoretischen Einführung der SuS in die Grundlagen der Fotometrie habe ich mich für die Untersuchung von Permanganatlösungen entschieden und das aus mehreren Gründen:
- Wässrige Redoxsysteme kann man sowieso nicht genug üben
- Kaliumpermanganat lässt sich auch zur Gewässeranalyse trefflich einsetzen zur Bestimmung des Anteil an oxidierbaren Substanzen und unser Haupthema ist die Gewässeranalyse (didaktische Integration/Kombination möglich)
- Permanganatlösung haben über eine recht breiten Spektralbereich eine brauchbar hohe Extinktion – da kann man nicht viel falsch machen
- Auch sehr niedrigkonzentrierte Lösungen c(KMnO4) = 0,001mol/L haben schon satt Farbe, woran sich die Empfindlichkeit des Verfahrens zeigen lässt
Die Stunde sah folgendermaßen aus (das Prinzip der Fotometrie war den SuS bereits bekannt):
Schritt 1: Aufnahme eines Vollspektrums zur Bestimmung einer geeigneten Wellenlänge für die Messung
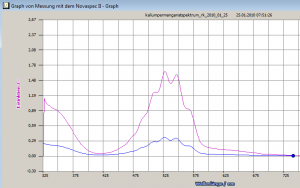
Das ist mit der Kappenberg-Software supersimpel. Das Spektrum sah so aus:
Vor der Aufnahme des Spektrum muss noch eine Basislinie aufgenommen werden, da das Novaspec II ein Einstrahlfotometer ist – das fragt die Software aber auch von sich aus. Ab einer Wellenlänge von 675nm absobiert die Lösung nicht mehr nennenswert, wohl aber im Infrarotbereich – das wäre auch nochmal interessant. Die blaue Linie repräsentiert eine niedrigkonzentrierte, die rote eine höherkonzentrierte Lösung. Die Analyse des Spektrum ergab, dass die Probelösungen bei einer Wellenlänge von ca. 527–529nm die größte Extinktion aufweisen, dort also der geringste Messfehler zu erwarten ist.
Die Aufnahme des Vollspektrums dauert recht lange – da kann man trefflich z.B. das Redoxsystem Kaliumpermanganat/Oxalsäure als Vorbereitung der Redoxtitration von Oberflächenwasser besprechen.
Schritt 2: Bestimmung von εi
Das Lambert-Beersche Gesetz lautet:
Eλ = εi * c * d
Mit:
Eλ: Extinktion bei Wellenlänge λ
εi: dekadischer, molarer Extinktionskoeffizient bei der Wellenlänge λ
c: Konzentration der Lösung in [mol/L]
d: Schichtdicke der Küvette in [cm]
Wenn also Eλ , c und d bekannt sind, lässt sich εi bestimmen, d.h. man misst eine Lösung bekannter Konzentration. Eine Permanganatlösung von c = 0,001mol ergab bei einer Schichtdicke von 1cm und der Wellenlänge 527nm (Achtung: Dieser Wert ist aufgrund der beschränkten Möglichkeiten in einer Schule mit Vorsicht zu genießen und taugt keinesfalls als „Literarturwert“, vgl. Kommentare).
E527nm = 1,006 [dimensionslos]
<=> εi = 1006 [L/(mol*cm)]
Schritt 3: Bestimmung der Konzentration einer Permanganatlösung unbekannter Konzentration
Die Probe ergab eine Extinktion von:
E527nm = 1,66 [dimensionslos]
<=> c = 0,00165 mol/L
Eigentlich:
… muss man für die Konzentrationen in dem Messbereich noch eine Eichkurve aufnehmen, d.h. mit verschiedenen, bekannten Konzentrationen die Extinktion gegen die Konzentration auftragen. Nur in dem Bereich, in dem eine Regressionsgerade (Lambert-Beer beschreibt ja eine Proportionalität) eine Güte von ungefähr 0,95 hat, ist auch in der Schule die Anwendung dieses Messverfahrens zulässig. Hier kann man aus der Stunde also noch mehr herausholen, etwa mit einer Verdünnungsreihe. Das Lambert-Beersche Gesetz gilt nur bei hinreichend verdünnten Lösungen. Bei Permanganat in dem betrachteten Konzentrationsbereich sollte die Gültigkeit noch gegeben sein – ließe sich jedoch auch schnell überprüfen.


hallo maik,
vom ak kappenberg gibt’s ja auch tauchphotometer. ich weiß jetzt gerade nicht, wie teuer die sind, doch sie stellen womöglich eine gute alternative dar. hieraus ergeben sich auch weitere anwendungsmöglichkeiten.
schönen gruß auch
rainer
Hallo Rainer,
Hab‘ ich mir gerade angesehen. Für fotometrische Titrationen oder die fotometrisch indizierte Endpunktbestimmung (rosa oder nicht rosa?) könnte das sehr interessant sein – jedoch nur mit dem externen Sensor – alles andere geht mit dem Novaspec II ja auch…
Auf jeden Fall werde ich das zukünftig auch für die Kinetik einsetzen, z.B. Geschwindigkeitsgesetze (Iodierung von Aceton, Entfärbung von Kristallviolett usw.).
Hallo,
ich betreue Physikpraktika für Nebenfächler an der Uni und einer der Versuche ist, den Extiktionskoeffizienten von Kaliumpermanganat (verdünnte Lösung) bei 525nm zu bestimmen. Die Versuchsergebnisse liegen regelmäßig in einem Bereich von etwa 2200 l/mol*cm, mittlerweile wohl hunderte Male bei vier verschiedenen Aufbauten. Einige meiner Praktikanten haben den von Ihnen ermittelten Wert als Literaturwert angegeben, darum bin ich auf diese Seite aufmerksam geworden. Ist es möglich, dass ihnen bei der Messung ein Fehler unterlaufen ist?
@Reichert
Hm – 2200 L/mol*cm – ich habe den leisen Verdacht, dass ich die Schichtdicke der Küvetten noch einmal überprüfen sollte – bei 0,5cm hätte ich enen Extinktionskoeffizienten von 2012 L/mol*cm – 10% darf man in der Schule schon neben der Universität liegen…
Davon losgelöst:
Bestellen Sie bitte Ihren Studis einen schönen Gruß von mir – Werte übernimmt man dann doch besser aus anerkannten Nachschlagewerken denn aus dem Internet.
Vielen Dank für den Hinweis!
Maik Riecken